¿Cómo se puede determinar el número de neutrones en un átomo? – Recursos de Química para Escuela Secundaria/Honores/AP®

¿Cómo determinamos el número de neutrones en un átomo determinado?
Primero, definamos algunos términos con los que deberá estar familiarizado. el número atómico de un átomo es el numero de protones en el núcleo de ese átomo. El número de masa (también llamado número de nucleones) de un átomo es el número total de protones y neutrones en el núcleo de ese átomo. Finalmente, la masa atómica relativa (símbolo Aᵣ) de un elemento es la promedio ponderado de las masas atómicas de cada isótopo de ese elemento. La unidad de esta cantidad es la unidad de masa atómica (uma), que se define como 1/12 de la masa de un átomo de carbono-12, es decir, el isótopo del carbono con 6 protones y 6 neutrones.
Para la masa atómica relativa, debemos tomar un promedio ponderado porque algunos isótopos son más abundantes que otros; esto significa que hay más de algunos isótopos que existen en la naturaleza, por lo que la masa promedio de los átomos de ese elemento estará más cerca de la masa. de los isótopos que son más comunes.
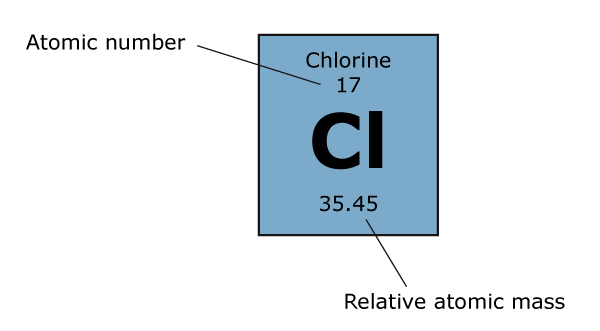
Es mucha información; veamos el cloro como ejemplo. El cloro tiene dos isótopos que existen en cantidad importante, Cl-35 (75%) y Cl-37 (25%). Recuerde que los números del símbolo son los números de masa, por lo que Cl-35 tiene un total de 35 protones y neutrones, y Cl-37 tiene un total de 37 protones y neutrones. Como sabemos que el número atómico del Cl es 17, podemos calcular que el Cl-35 tiene 18 neutrones y el Cl-37 tiene 20 neutrones. Recuerde: el número atómico de un elemento es constante para todos los isótopos, ya que es el número de protones el que realmente define qué elemento es un átomo. Para calcular la masa atómica relativa del cloro tenemos que tomar el promedio ponderado, por lo que el cálculo queda así: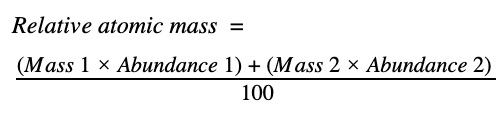
Para el cloro, cuando tomamos los dos isótopos Cl-35 y Cl-37, obtenemos: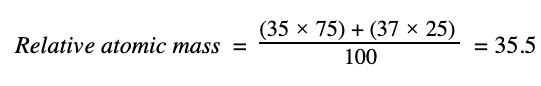
La verdadera respuesta, 35,45, que aparece en la tabla periódica, proviene de todos los demás isótopos menores que no consideramos, pero 35,5 es una respuesta suficientemente buena porque todos estos otros isótopos no son realmente relevantes. Notarás que de todos modos 35,45 se convierte en 35,5 con tres cifras significativas.
Determinación del número de neutrones.
Entonces ¿qué pasa con los neutrones? Vimos en el ejemplo del cloro que para un isótopo específico de un elemento, si conocemos el número de masa de ese isótopo, podemos calcular el número de neutrones en un átomo de ese isótopo tomando n -número de masa (número total de protones y neutrones) y reducir el número atómico (número de protones). Esto nos deja con la cantidad de neutrones en ese isótopo.
Pero, ¿cómo descubren los científicos qué isótopos de un elemento existen en proporciones significativas? La clave es la espectrometría de masas. La espectrometría de masas es una forma de medir qué isótopos están presentes en una muestra determinada de un elemento. Si tomamos un espectro de masas de cloro, por ejemplo, obtenemos un gráfico parecido a este:
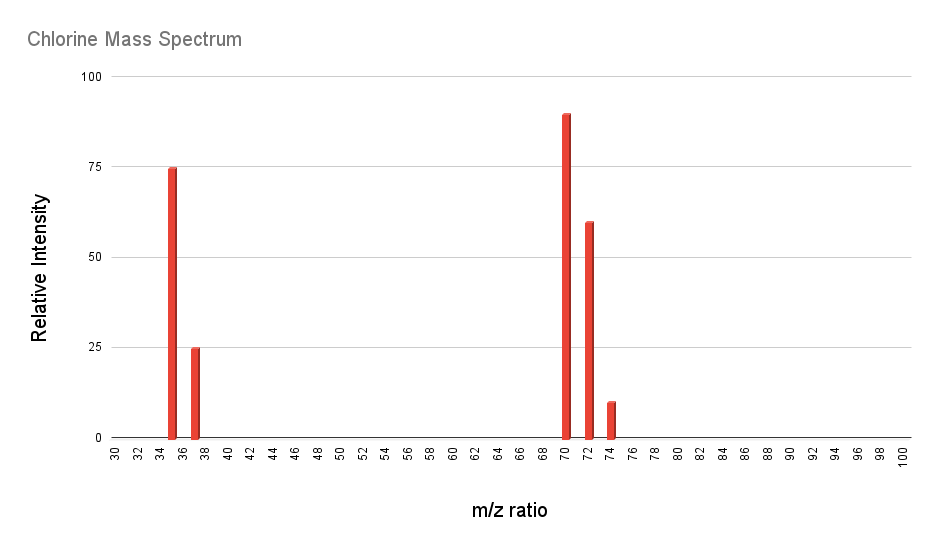
El eje y corresponde a la abundancia relativa de cada señal, el eje x es la relación masa-carga, m/z. Para este espectro las cargas son todas +1, por lo que este eje corresponde únicamente a la masa de los isótopos que da cada señal. Sabemos que el cloro existe como gas diatómico, Cl2 – es por eso que vemos señales por encima de 70. La parte más interesante son las dos señales en 35 y 37. Estas corresponden a átomos de cloro, específicamente los isótopos Cl-35 y Cl-37. Las abundancias están aproximadamente en una proporción de 3:1, y así es como un científico determinará qué isótopos existen y en qué cantidades relativas están presentes. El espectro anterior se simplifica un poco, ya que también hay cantidades muy pequeñas de otros isótopos, pero no debemos preocuparnos por ellos.

Nombre del autor: Ronan Haskurti
Título: BA (Hons) Ciencias Naturales
Universidad: Universidad de Cambridge, Reino Unido



