Determinación de carbohidratos, almidón, proteínas y lípidos en diferentes soluciones.

Introducción
Los carbohidratos, proteínas, lípidos y ácidos nucleicos son moléculas orgánicas fundamentales presentes en los organismos vivos. Estas macromoléculas biológicas contienen carbono y también pueden incluir hidrógeno, oxígeno, nitrógeno, fósforo, azufre y otros elementos menores. Los carbohidratos, formados por unidades de monosacáridos, funcionan principalmente en el almacenamiento de energía (Mika et al., 2024). La presencia de macromoléculas se determina mediante varios métodos. Por ejemplo, la presencia de azúcares reductores se detecta utilizando el reactivo de Benedict, que cambia de color de verde a rojizo tras la oxidación de los iones cúpricos (Benedict, 2002). El almidón, un polisacárido con largas cadenas de unidades de glucosa, se identifica mediante la prueba del yodo, que se vuelve negro azulado en presencia de almidón debido a la interacción del yodo con la estructura helicoidal del polímero. Las proteínas, que constan de largas cadenas de aminoácidos, desempeñan funciones críticas como la actividad enzimática, el transporte molecular y el soporte estructural (Pesek et al., 2022). La prueba de Biuret detecta proteínas formando un complejo violeta con iones de cobre que se unen a enlaces peptídicos (Lubran, 1978). Los lípidos, que incluyen grasas, aceites y fosfolípidos, participan principalmente en el almacenamiento de energía y la estructura de las membranas. La presencia de lípidos se confirma mediante la prueba de la mancha de grasa, donde los lípidos dejan una marca translúcida en el papel (Grease Spot Test, n.d.).
En este experimento, se realizaron la prueba de Benedict, la prueba de yodo, la prueba de Biuret y la prueba de la mancha de grasa para determinar cualitativamente la presencia de carbohidratos, almidón, proteínas y lípidos en varias soluciones, respectivamente (Mika et al., 2024). La hipótesis de este experimento es que, si en las soluciones probadas están presentes carbohidratos, almidón, proteínas y lípidos, entonces la prueba de Benedict produce un cambio de color que indica la presencia de azúcares reductores, la prueba de yodo resulta en azul-negro. un color que confirma el almidón, la prueba de Biuret dará un color púrpura que muestra la presencia de proteínas, y la prueba de la mancha grasa revela una marca translúcida que indica la presencia de lípidos.
Materiales y métodos
Para detectar carbohidratos se realizó la prueba de Benedict (Mika et al., 2024). Se prepararon ocho tubos de ensayo, cada uno de los cuales contenía 10 gotas de una solución diferente: jugo de cebolla, jugo de papa, solución de sacarosa, solución de glucosa, agua destilada, solución de fructosa, almidón y quimo. A cada tubo de ensayo se le añadió 1 ml de reactivo de Benedict y se registró el color inicial. Luego se colocaron los tubos de ensayo en un baño de agua hirviendo durante 3 minutos. Después de enfriar, se anotó y analizó el color final de cada solución para determinar la presencia de carbohidratos.
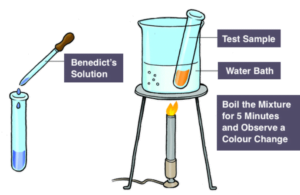
Para la detección de almidón se realizó la prueba de yodo siguiendo un procedimiento similar al test de Benedict. En lugar del reactivo de Benedict, se agregaron de 4 a 6 gotas de solución de yodo a cada tubo de ensayo que contenía el mismo conjunto de soluciones (Mika et al., 2024). En esta prueba no se realiza ebullición.
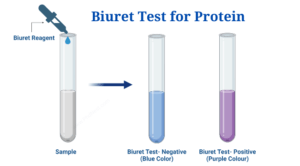
La presencia de proteínas se evaluó mediante la prueba de Biuret. Se prepararon seis tubos de ensayo con 2 ml de cada una de las siguientes soluciones: albúmina de huevo, miel, aminoácidos, agua destilada, solución proteica y quimo. Se registró el color inicial de cada solución. A cada tubo de ensayo se le añadió 1 ml de solución de NaOH al 2,5%, seguido de 8 a 10 gotas de reactivo de Biuret. Las soluciones se mezclaron lentamente y se observó cualquier cambio de color para determinar la presencia de proteínas (Mika et al., 2024).
Los lípidos se detectaron mediante la prueba de la mancha grasa. Se cortaron seis pequeños cuadrados de una bolsa de papel marrón y se etiquetaron en consecuencia. Se colocó una gota de cada una de las siguientes sustancias en cuadrados separados: jarabe de arce, jarabe de chocolate, aceite de canola, mantequilla de maní, hielo y quimo. Se dejaron secar los cuadrados y se observó la presencia de una mancha de grasa translúcida para confirmar la presencia de lípidos (Mika et al., 2024).
Resultados
En la prueba de Benedict, sólo el jugo de cebolla cambió de color de azul a verde, lo que indica la presencia de azúcar reductor. Todas las demás muestras permanecieron azules, lo que demuestra que no había azúcares reductores.
Tabla 1: Resultados de la prueba de Benedict
| un tubo | Solución (10 gotas) | Color inicial | Color después de hervir |
| 1 | jugo de cebolla | Blanco | Verde |
| 2 | jugo de papa | Marrón | Azul |
| 3 | solución de sacarosa | Claro | Azul |
| 4 | solución de glucosa | Claro | Azul |
| 5 | Agua destilada | Claro | Azul |
| 6 | solución de fructosa | Claro | Azul |
| 7 | solución de almidón | Claro | Azul |
| 8 | Productos unidos | leche amarilla | Azul |
En la prueba de yodo, todas las soluciones se volvieron marrones después de la adición de yodo, lo que significa ausencia de almidón en todas las muestras.
Tabla 2: Resultados de la prueba de yodo
| un tubo | Solución (10 gotas) | Color inicial | Color después del yodo |
| 1 | jugo de cebolla | Blanco | Marrón |
| 2 | jugo de papa | Marrón | Marrón |
| 3 | solución de sacarosa | Claro | Marrón |
| 4 | solución de glucosa | Claro | Marrón |
| 5 | Agua destilada | Claro | Marrón |
| 6 | solución de fructosa | Claro | Marrón |
| 7 | solución de almidón | Claro | Marrón |
| 8 | Productos unidos | leche amarilla | Marrón |
La prueba de Biuret mostró la presencia de proteínas en la albúmina de huevo, la solución proteica y el quimo, como lo demuestra el cambio de color púrpura. Todas las demás muestras permanecieron azules, lo que indica que no hay presencia de proteínas.
Tabla 3: Resultados de la prueba Biuret
| un tubo | Solución (2ml) | Color inicial | Color según Biuret |
| 1 | Solución de albúmina de huevo | Claro | Violeta |
| 2 | Solución de miel | Amarillo | Azul |
| 3 | Solución de aminoácidos | Amarillo | Azul |
| 4 | Agua destilada | Claro | Azul |
| 5 | Solución proteica | Claro | Violeta |
| 6 | Productos unidos | Amarillo | Violeta |
En la prueba de las manchas de grasa, se encontraron lípidos en el aceite de canola, la mantequilla de maní y el hielo, como lo indica la formación de manchas aceitosas grandes y visibles. En las demás muestras no se observaron manchas aceitosas.
Tabla 4: Resultados de la prueba Fat Pot
| un tubo | Solución (una gota) | Descripción de la reacción de la mancha de grasa |
| 1 | Jarabe de arce | Las manchas no se movían, no había grasa. |
| 2 | jarabe de chocolate | Las manchas no se movían, no había grasa. |
| 3 | aceite de canola | La mancha se hizo más grande y aceitosa. |
| 4 | Manteca de cacahuete | La mancha se hizo más grande y aceitosa. |
| 5 | Hielo | La mancha se hizo más grande y aceitosa. |
| 6 | Productos unidos | La mancha no se movió, líquida, sin grasa. |
Discusión
Los resultados apoyan la hipótesis de que la presencia de carbohidratos, almidón, proteínas y lípidos provoca cambios de color específicos (verde, naranja, rojo ladrillo, morado y la aparición de una mancha aceitosa) cuando se aplican sus respectivos reactivos. El análisis cualitativo de las muestras que evalúa el cambio de color ayuda a determinar la macromolécula específica en la solución.
La prueba de Benedict indicó la presencia de azúcar reductor en el jugo de cebolla, la cual cambió el color a verde (Cuadro 1). Este cambio de color confirma la presencia de azúcares reductores, ya que pueden reducir los iones cúpricos a óxido de cobre. Por el contrario, las otras muestras no cambiaron de color, lo que indica la ausencia de azúcar reductor (Benedict, 2002).
La prueba de yodo no reveló presencia de almidón en ninguna de las muestras, incluida la propia solución de almidón (Tabla 2). Normalmente, el yodo forma un complejo azul-negro con el almidón, pero la falta de cambio de color en nuestras pruebas sugiere que el almidón se degradó o que la solución de yodo fue ineficaz (Pesek et al., 2022). Las soluciones de almidón tienen una vida útil limitada y pueden degradarse con el tiempo, lo que puede explicar los resultados negativos. Además, los problemas con la solución de yodo pueden haber contribuido a la falta de respuesta.
La prueba de Biuret mostró la presencia de proteínas en la albúmina de huevo, la solución proteica y el quimo, como lo demuestra el cambio de color púrpura (Cuadro 3). La falta de cambio de color en la solución de aminoácidos puede explicarse por la falta de enlaces peptídicos; el reactivo de Biuret reacciona específicamente con enlaces peptídicos y los aminoácidos individuales no contienen estos enlaces, lo que no produce cambio de color (Lubran, 1978).
En la prueba de las manchas de grasa, se encontraron lípidos en el aceite de canola, la mantequilla de maní y el hielo, lo que produjo manchas aceitosas visibles (Tabla 4). La ausencia de manchas aceitosas en el jarabe de arce, el jarabe de chocolate y el quimo confirmó la ausencia de lípidos en estas muestras. La prueba de la mancha de grasa es eficaz para detectar lípidos debido a su capacidad para crear un residuo aceitoso en el papel (prueba de la mancha de grasa, n.d.).
Para mejorar la confiabilidad experimental, es importante utilizar soluciones recién preparadas e incorporar controles positivos y negativos en cada prueba. Por ejemplo, la prueba de yodo para el almidón no tuvo un control positivo, lo que dificulta la interpretación precisa de los resultados. La inclusión de una muestra positiva conocida habría aclarado si el problema estaba en la solución de almidón o en el reactivo de yodo.
Más experimentos
Para mejorar el análisis de carbohidratos, almidón, proteínas y lípidos, se pueden utilizar métodos cuantitativos como el análisis colorimétrico y la extracción Soxhlet para medir las concentraciones con mayor precisión. Además, la incorporación de ensayos de actividad enzimática específica y técnicas avanzadas como la cromatografía en capa fina ofrece información sobre las propiedades bioquímicas y los tipos de estas macromoléculas.
Referencias
- Benedicto SR (2002). Reactivo para la detección de azúcares reductores. 1908. La revista de química biológica., 277(16), e5.
- Lubrán MM (1978). Medición de proteínas séricas totales mediante el método Biuret. Anales de ciencia clínica y de laboratorio., 8(2), 106-110.
- Prueba de mancha de grasa. (Dakota del Norte.). Métodos de identificación de lípidos. Recogido por [https://cdn.agclassroom.org/media/uploads/LP841/Grease_spot_test_student_instruction s.pdf]
- Pesek, S., Lehene, M., Brânzanic, AMV y Silaghi-Dumitrescu, R. (2022). Sobre el origen del color azul en el complejo supramolecular de yodo/yoduro/almidón. Moléculas (Basilea, Suiza), 27(24), 8974.
https://doi.org/10.3390/molecules27248974
- Mika, TA, Klein, RJ, Bullerjahn, AE, Connor, RL, Nadador, LM, White, R.
E., Gosses, MW, Carter, TE, Andrews, AM, Maier, JL y Sidiq, F. (Eds.). (2024). BIO 211 manual de laboratorio de anatomía y fisiología (tercera ed.). Colegio Comunitario Owens.
Aminoácidos: tipos, funciones, fuentes y diferencias entre aminoácidos esenciales y no esenciales (thesciencenotes.com)



