Un nuevo catalizador revoluciona la producción de hidrógeno

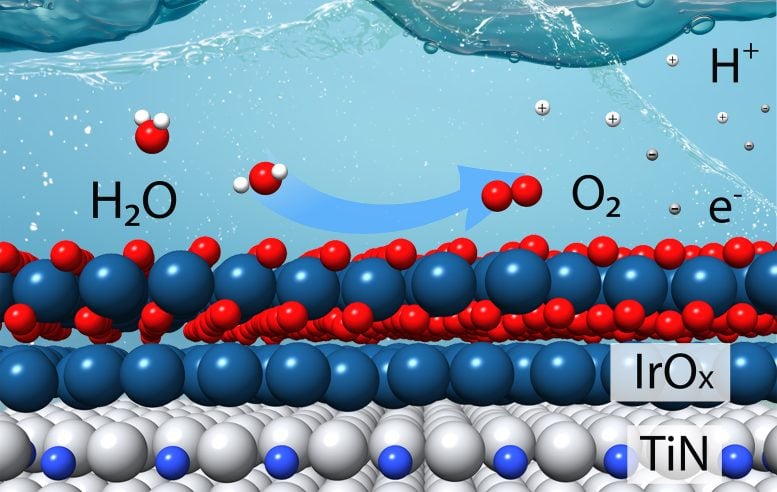
Este esquema muestra cómo un catalizador hecho de pocas capas de óxido de iridio (IrOX) sobre un soporte hecho de nitruro de titanio (TiN) puede producir eficientemente oxígeno (O2), iones de hidrógeno (H+) y electrones (p. ej.–) de moléculas de agua (H2O) en un electrolito ácido. Esta «reacción de evolución de oxígeno» es la más desafiante de las dos reacciones necesarias para dividir el agua y producir gas hidrógeno (H2). Crédito: Tianyou Mou/Laboratorio Nacional de Brookhaven
Una demostración exitosa podría mejorar la producción de hidrógeno a partir del agua.
Hidrógeno (H2) tiene un gran potencial como combustible para reducir los gases de efecto invernadero, particularmente cuando se produce utilizando energía renovable para dividir las moléculas de agua (H2O). Sin embargo, a pesar de la aparente simplicidad de descomponer el agua en hidrógeno y oxígeno, la química subyacente es bastante compleja.
Dos reacciones electroquímicas simultáneas separadas requieren cada una de catalizadores, «negociadores» químicos que ayudan a romper y rehacer los enlaces químicos. Ahora, los científicos del Laboratorio Nacional Brookhaven del Departamento de Energía de EE. UU. (DOE) y la Universidad de Columbia dicen que han desarrollado un nuevo catalizador eficiente para la parte más desafiante: la reacción de evolución del oxígeno.
Como se describe en un artículo recién publicado en el Revista de la Sociedad Química Estadounidense, el catalizador fue diseñado «de abajo hacia arriba» basándose en cálculos teóricos que buscan minimizar la cantidad de iridio, un metal costoso utilizado como material catalítico, y maximizar la estabilidad del catalizador en condiciones ácidas. Cuando el equipo creó modelos del catalizador y los probó en el laboratorio, los resultados validaron las predicciones. Luego, los científicos fabricaron el catalizador en forma de polvo, como los que se utilizan en aplicaciones industriales, y demostraron que puede producir hidrógeno de manera eficiente en un electrolizador que divide el agua.
«En esta prueba del mundo real, nuestro catalizador es aproximadamente cuatro veces mejor que el catalizador de iridio de última generación disponible comercialmente», dijo Jingguang Chen, ingeniero químico de Universidad de Colombia con un nombramiento conjunto en la División de Química del Brookhaven Lab que realizó la investigación. En otras palabras, el nuevo catalizador necesita cuatro veces menos iridio para producir hidrógeno al mismo ritmo que la variedad comercial, o produce hidrógeno cuatro veces más rápido con la misma cantidad de iridio.
El químico teórico del Brookhaven Lab, Ping Liu, quien dirigió los cálculos que sustentan el diseño del catalizador, dijo: «Este estudio muestra cómo se puede pasar de una comprensión basada en la teoría de lo que sucede a nivel atómico al diseño de un catalizador para uso práctico. Nuestro trabajo nos da una mejor comprensión de cómo funciona este catalizador y nos acerca a la aplicación en el mundo real».
El desafío restante es aumentar la producción.
«Sólo producimos miligramos de catalizador por lote», dijo Chen. “Si quieres producir megatones de hidrógeno verde, necesitas kilogramos o toneladas de catalizador. No podemos hacer esto a gran escala todavía».
La reducción del iridio.
El iridio es el catalizador elegido para la reacción de desprendimiento de oxígeno, que se produce en el ánodo de un electrolizador. Proporciona los sitios activos cargados eléctricamente que separan los iones de hidrógeno fuertemente unidos (H+) del oxígeno (O). Además de la liberación de H+ iones, que contribuyen a las condiciones de reacción altamente ácidas, la reacción produce oxígeno gaseoso (O2) y electrones. Esos electrones son necesarios para la segunda reacción de «evolución de hidrógeno», menos desafiante: el emparejamiento de iones de hidrógeno para formar gas hidrógeno en el cátodo del electrolizador.
«Actualmente, el iridio es uno de los únicos elementos estables para la reacción de desprendimiento de oxígeno. ácido”, dijo Chen. Esto es «desafortunado», señaló, porque «el iridio es aún más raro y más caro que el platino».
De ahí la motivación para reducir la cantidad de iridio.
“En catalizadores industriales hechos de nanoescala partículas, sólo los átomos de la superficie participan en la reacción”, dijo Chen. «Esto significa que la mayor parte del iridio del interior de la partícula se desperdicia».
Tal vez en lugar de utilizar una partícula que sea enteramente iridio, se podría hacer un catalizador de un material menos costoso con solo iridio en la superficie, razonó el equipo.
Con financiación de una iniciativa del DOE para avanzar en tecnologías de energía limpia, estaban explorando el uso de abundantes elementos terrestres como el titanio. Descubrieron que la combinación de titanio con nitrógeno proporcionaba suficiente estabilidad para que estos «nitruros de titanio» sobrevivieran en condiciones de reacción ácida. Quizás el nitruro de titanio pueda servir como núcleo de partículas catalíticas recubiertas de iridio.
Pero, ¿cuánto iridio se debe colocar encima? Aquí es donde entran los cálculos teóricos.
Cálculo de una estructura ideal.
«Utilizamos cálculos de la ‘teoría funcional de la densidad’ para modelar cómo las diferentes capas de iridio sobre nitruro de titanio afectan la estabilidad y la actividad del catalizador en condiciones de reacción ácida de evolución de oxígeno», dijo Liu. Ella y su equipo utilizaron recursos informáticos en el Centro de Nanomateriales Funcionales (CFN) del Brookhaven Lab y en el Centro Nacional de Computación Científica de Investigación Energética (NERSC) en el Laboratorio Nacional Lawrence Berkeley del DOE para ejecutar las simulaciones.
Los cálculos predijeron que una sola capa de iridio no sería suficiente para impulsar la reacción de desprendimiento de oxígeno, pero que dos o tres capas mejorarían tanto el rendimiento como la estabilidad catalítica.
«Estos fueron una especie de experimentos de preselección», dijo Liu. «Luego, transmitimos estos resultados de detección al equipo experimental para fabricar catalizadores reales y evaluar su actividad catalítica».
Validación de predicciones
Primero, el equipo creó películas delgadas en las que podían crear capas cuidadosamente controladas que se parecían mucho a las superficies utilizadas en los cálculos del modelado teórico. También crearon muestras de polvo compuestas de pequeñas partículas a nanoescala, la forma que adopta el catalizador en aplicaciones industriales. Luego, estudiaron las películas delgadas, incluidas las interfaces entre las capas, y las nanopartículas utilizando una variedad de técnicas.
Estos incluyeron microscopía electrónica de transmisión en CFN y estudios de espectroscopía de rayos X en la línea de luz de dispersión y absorción rápida de rayos X (QAS) de la Fuente Nacional de Luz Sincrotrón II (NSLS-II), una potente fuente de rayos X para descifrar las muestras. propiedades químicas y físicas.
«Nuestra hipótesis era que si el iridio se une al nitruro de titanio, este enlace estabilizará el iridio y mejorará la reacción», dijo Chen.
Los estudios de caracterización han confirmado las predicciones.
«Los estudios de sincrotrón revelaron los estados de oxidación y el entorno de coordinación local de los átomos de iridio y titanio en condiciones de reacción», dijo Chen. «Confirmaron que el iridio y el titanio interactúan fuertemente».
«El mapeo de los elementos de las nanopartículas en CFN confirmó los tamaños y composiciones de las partículas, incluida la presencia de óxidos de iridio en la superficie de los soportes de nitruro de titanio», añade.
Liu enfatizó que los estudios de caracterización informaron la comprensión de los científicos sobre el catalizador.
«Descubrimos que la interacción entre el iridio y el titanio no sólo es útil para la estabilidad del catalizador sino también para ajustar su actividad», dijo. «Las cargas cambian la química de una manera que mejora la reacción».
Específicamente, las cargas transferidas del titanio a la superficie del iridio cambian la estructura electrónica de los sitios activos del iridio para optimizar la unión de los intermediarios de la reacción, explicó.
«Al pasar de una a tres capas de iridio, se aumenta significativamente la transferencia de carga del nitruro al iridio superior», señaló Liu. Pero la diferencia entre dos y tres capas no era muy grande. Dos capas pueden ser suficientes para permitir una alta estabilidad, actividad y bajo costo.
Para que este catalizador esté listo para su uso en el mundo real, los científicos señalaron que, además de abordar el desafío de aumentar la producción, también podría haber mejoras para optimizar la consistencia del polvo.
«Cuando hacemos películas delgadas, podemos controlar las capas, pero con la síntesis de polvo, no tenemos ese tipo de control», dijo Chen. “Nuestras partículas de polvo no tienen una capa continua de iridio a su alrededor. Pero este estudio proporciona pautas que los químicos industriales pueden utilizar para crear verdaderas estructuras centrales con una fina capa uniforme de iridio», dijo.
Estos catalizadores podrían ayudar a reducir el coste de la división del agua y acercar a los científicos a la producción de grandes cantidades de hidrógeno verde.
Referencia: «Predicción teórica y verificación experimental de IrOx soportado en nitruro de titanio para la reacción de evolución de oxígeno ácido» por Xue Han, Tianyou Mou, Arephin Islam, Sinwoo Kang, Qiaowan Chang, Zhenhua Xie, Xueru Zhao, Kotaro Sasaki, José A. Rodriguez, Ping Liu y Jingguang G. Chen, 10 de junio de 2024, Revista de la Sociedad Química Estadounidense.
DOI: 10.1021/jacs.4c02936
Este trabajo fue financiado por la Oficina de Ciencias del DOE. CFN, NSLS-II y NERSC operan como instalaciones para usuarios de la Oficina de Ciencias del DOE.
El Laboratorio Nacional Brookhaven cuenta con el apoyo de la Oficina de Ciencias del Departamento de Energía de EE. UU.



