La química de la vida: átomos, elementos e isótopos

La química es el estudio científico de la materia, incluida su estructura, propiedades y los cambios que sufre. En la base de la química se encuentra el concepto de átomos y elementos. Estas unidades fundamentales desempeñan un papel crucial en la química de la vida, particularmente en la comprensión de la composición y función del cuerpo humano. Esta nota explora la estructura básica de los átomos, la distinción entre átomos y elementos, los elementos principales del cuerpo humano y el papel de los isótopos y radioisótopos en la química.
Átomos y estructura atómica
Los átomos son las unidades más pequeñas de materia que contienen las propiedades químicas de un elemento. Consisten en tres partículas subatómicas primarias: protones, neutrones y electrones.
- Protones Son partículas cargadas positivamente que se encuentran en el núcleo atómico. Tienen una masa de aproximadamente 1 unidad de masa atómica (uma). El número de protones en un átomo define el elemento y se conoce como número atómico. Por ejemplo, todos los átomos de carbono tienen 6 protones.
- Neutrones son partículas neutras (es decir, que no tienen carga) que también residen en el núcleo. Son un poco más grandes que los protones y tienen una masa de aproximadamente 1 uma. Los neutrones contribuyen a la masa atómica pero no afectan la carga del átomo.
- electrones son partículas cargadas negativamente con una masa insignificante en comparación con los protones y neutrones. Orbitan alrededor del núcleo en regiones llamadas capas de electrones. A pesar de su masa mínima, los electrones son cruciales en los enlaces y las reacciones químicas.
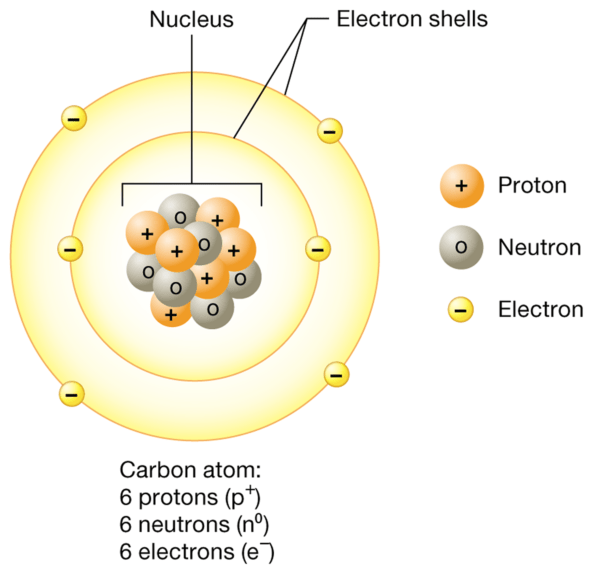
El núcleo, que contiene protones y neutrones, es increíblemente denso en comparación con las capas de electrones, que son relativamente vastas. Aunque los electrones están repartidos en un gran volumen, la mayor parte de la masa de un átomo se concentra en el núcleo.
Conchas de electrones
El modelo clásico del átomo muestra electrones orbitando el núcleo de forma similar a los planetas alrededor del sol. Sin embargo, esto es una simplificación. Los electrones existen en regiones de probabilidad conocidas como capas de electrones. La primera capa puede contener hasta 2 electrones, la segunda capa hasta 8 y la tercera capa hasta 18. Los electrones llenan primero los niveles (o capas) de energía más altos antes de ocupar los superiores. Esta disposición influye en cómo interactúan químicamente los átomos.
Átomos versus elementos
Los términos «átomo» y «elemento» se utilizan a menudo indistintamente pero tienen significados distintos:
- un atomo: Un átomo es la unidad más pequeña de un elemento que conserva sus propiedades químicas. Está formado por protones, neutrones y electrones. Los átomos pueden combinarse para formar moléculas, que son los componentes básicos de la materia.
- Elemento: Un elemento es una sustancia pura que consta de un solo tipo de átomo. Los elementos se definen por su número atómico, que es el número de protones en sus átomos. Por ejemplo, el hidrógeno (H) es un elemento cuyos átomos tienen un protón. Actualmente existen 118 elementos conocidos, cada uno con propiedades únicas.
Elementos principales del cuerpo humano
El cuerpo humano se compone principalmente de unos pocos elementos clave, que son esenciales para diversas funciones biológicas:
- Oxígeno (O): El oxígeno, que representa aproximadamente el 65% de la masa del cuerpo humano, es crucial para la respiración celular, el proceso mediante el cual las células generan energía.
- Carbono (C): Incluye aproximadamente el 18% del cuerpo, el carbono es la columna vertebral de las moléculas orgánicas, incluidos los carbohidratos, proteínas, lípidos y ácidos nucleicos.
- Hidrógeno (H): Constituye aproximadamente el 10% del cuerpo, el hidrógeno es un componente del agua y de las moléculas orgánicas, que desempeña un papel vital en el mantenimiento del equilibrio del pH y la producción de energía.
- Nitrógeno (N): El nitrógeno, que representa aproximadamente el 3% del cuerpo, es un elemento clave en los aminoácidos, que son los componentes básicos de las proteínas, y en los ácidos nucleicos, que forman el ADN y el ARN.
Otros elementos, como el calcio, el fósforo, el potasio, el azufre, el sodio y el magnesio, están presentes en cantidades menores pero siguen siendo esenciales para mantener la salud y favorecer diversas funciones fisiológicas.
Número atómico, número másico, isótopos y radioisótopos
Para comprender la variación entre átomos, debemos distinguir entre número atómico, número másico, isótopos y radioisótopos:
- Número atómico: El número atómico es el número de protones en el núcleo de un átomo. Define el elemento y su posición en la tabla periódica. Por ejemplo, el número atómico del carbono es 6, lo que significa que todos los átomos de carbono tienen seis protones.
- Número de la Misa: El número másico es la suma de protones y neutrones en el núcleo de un átomo. Representa la masa nuclear total del átomo. Por ejemplo, el carbono-12 tiene un número de masa de 12, lo que indica un total de 6 protones y 6 neutrones.
- Isótopos: Los isótopos son variantes de un mismo elemento que tienen el mismo número de protones pero diferente número de neutrones. Esto da como resultado diferentes números de masa. Por ejemplo, el carbono tiene tres isótopos: carbono-12 (6 protones y 6 neutrones), carbono-13 (6 protones y 7 neutrones) y carbono-14 (6 protones y 8 neutrones).
- Radioisótopos: Los isótopos radiactivos, o isótopos radiactivos, son isótopos inestables que se desintegran con el tiempo y emiten radiación en el proceso. Esta desintegración radiactiva cambia el isótopo a una forma más estable. Los radioisótopos se utilizan en diversas aplicaciones, incluidos diagnósticos y tratamientos médicos. Por ejemplo, el yodo-131 se utiliza en el tratamiento de trastornos de la tiroides.
Producción de isótopos
Los isótopos se producen mediante varios procesos nucleares:
- Procesos naturales: Algunos isótopos se encuentran de forma natural. Por ejemplo, el carbono-14 se forma continuamente en la atmósfera mediante la interacción de los rayos cósmicos con el nitrógeno-14.
- Procesos artificiales: Los isótopos también se pueden crear artificialmente en laboratorios o reactores nucleares. Al bombardear átomos estables con neutrones u otras partículas, los científicos pueden producir isótopos con diferentes números de masa. Por ejemplo, el tecnecio-99m, utilizado en imágenes médicas, se produce en reactores nucleares.
Conclusión
Comprender los conceptos básicos de la estructura atómica, la distinción entre átomos y elementos y las funciones de los isótopos y radioisótopos es fundamental en química y esencial para explorar la química de la vida. Estos conceptos ayudan a aclarar la composición y función de las moléculas biológicas y el uso de materiales radiactivos en medicina. Al comprender estos principios, podemos comprender cómo las unidades más pequeñas de materia contribuyen a los complejos procesos que sustentan la vida.


