Digestión de enzimas de restricción del ADN plásmido

El ADN plasmídico es una herramienta versátil en biología molecular, que se utiliza a menudo para diversas manipulaciones y estudios genéticos. La digestión con enzimas de restricción del ADN plasmídico es una técnica crucial que permite a los investigadores cortar el ADN con precisión en sitios específicos, facilitando aplicaciones posteriores como la clonación, la secuenciación y el mapeo. En este artículo, analizaremos los principios, procedimientos, reactivos y consejos asociados con la digestión con enzimas de restricción del ADN plasmídico.
Principio de digestión con enzimas de restricción
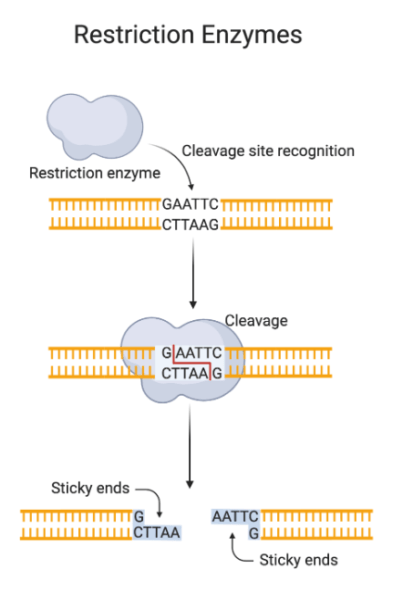
La digestión de restricción, también conocida como digestión con endonucleasas de restricción, implica la escisión del ADN en sitios de reconocimiento específicos mediante enzimas de restricción. Estas enzimas reconocen secuencias cortas y palindrómicas de nucleótidos y catalizan la hidrólisis de enlaces fosfodiéster en la columna vertebral del ADN. Esto da como resultado la formación de fragmentos con extremos planos o pegajosos, dependiendo de la enzima y su mecanismo de corte.
Importancia y aplicaciones
La digestión de restricción del ADN plasmídico es esencial para varias técnicas de biología molecular, que incluyen:
- Clonación molecular: La digestión por restricción permite la preparación de fragmentos de ADN que posteriormente pueden ligarse en vectores con fines de clonación.
- Análisis de secuencia: Proporciona un método para obtener indirectamente información de secuencia mediante el análisis de los patrones de fragmentos generados después de la digestión.
- Resúmenes de diagnóstico: Se utiliza para comprobar rápidamente la identidad de un plásmido verificando la presencia o ausencia de sitios de restricción específicos.
Reactivos necesarios
Para realizar la digestión con enzimas de restricción del ADN plasmídico, normalmente se utilizan los siguientes reactivos:
- ADN plásmido: La plantilla de ADN debe dividirse.
- Enzimas de restricción): Enzimas que reconocen y escinden secuencias específicas de ADN.
- Búfer de restricción: Proporciona pH óptimo y condiciones iónicas para la actividad enzimática.
- BSA (albúmina sérica bovina): Opcional, utilizado para estabilizar ciertas enzimas de restricción.
- Colorante de carga de gel y tampón de electroforesis: Para el análisis de fragmentos de ADN digeridos mediante electroforesis en gel.
Procedimiento de digestión con enzimas de restricción del ADN plasmídico
1. Selección de Enzimas de Restricción:
Seleccione las enzimas de restricción apropiadas según los sitios de escisión deseados y la naturaleza del fragmento de ADN requerido.
Consejo profesional: Utilice herramientas de análisis de secuencia para predecir con precisión los sitios de corte de enzimas.
2. Preparación de la Mezcla de Reacción:
Combine el ADN plasmídico, las enzimas de restricción, el tampón y cualquier componente adicional como BSA en un tubo de microcentrífuga.
Consejo profesional: Determine el tampón de reacción apropiado y la concentración de enzima según las instrucciones del fabricante.
3. Incubación:
Incubar la mezcla de reacción a la temperatura óptima para la actividad enzimática, normalmente 37 °C, durante un período de tiempo específico.
Consejo profesional: Asegúrese de que el tiempo de incubación sea adecuado para una digestión completa, teniendo en cuenta factores como la concentración de ADN y la actividad enzimática.
4. Análisis:
Después de la incubación, analice los fragmentos de ADN digeridos mediante electroforesis en gel para ver el patrón de escisión y los tamaños de los fragmentos.
Consejos para lograr el éxito en la digestión del ADN plásmido con enzimas de restricción
- Manejo adecuado de las enzimas: Asegúrese de que las enzimas se almacenen y manipulen de acuerdo con las instrucciones del fabricante para mantener la actividad.
- Optimización de las condiciones de reacción: Ajuste las condiciones del tampón, la concentración de enzimas y el tiempo de incubación para lograr una eficiencia de digestión óptima.
- Consideración de la sensibilidad a la metilación: Seleccione enzimas que sean compatibles con el estado de metilación del ADN.
- Control de calidad: Incluya controles positivos y negativos en cada experimento para validar la eficiencia de la digestión.
- Documentación y análisis: Documente los detalles experimentales y analice imágenes de gel con precisión para interpretar los resultados de manera efectiva.
Conclusión
La digestión con enzimas de restricción del ADN plasmídico es una técnica fundamental en biología molecular, que permite la manipulación y el análisis precisos del material genético. Al comprender los principios, optimizar las condiciones experimentales y seguir las mejores prácticas, los investigadores pueden utilizar con éxito esta técnica para una amplia gama de aplicaciones, avanzando nuestra comprensión de la genética y la biotecnología. En resumen, la digestión de restricción del ADN plasmídico sirve como piedra angular en la investigación de la biología molecular, ya que permite a los científicos explorar y manipular las complejidades del código genético. A través de una cuidadosa experimentación e innovación, esta técnica continúa impulsando avances en la biotecnología y más allá.
Solución de problemas de digestión de ADN plasmídico
La digestión del ADN plasmídico, un paso crítico en los experimentos de biología molecular, a veces puede encontrar desafíos que conducen a una escisión incompleta o fallida. Comprender los problemas potenciales e implementar estrategias efectivas de resolución de problemas es clave para lograr resultados confiables. En esta guía, exploraremos los problemas comunes que se encuentran durante la digestión del ADN plasmídico y brindaremos soluciones prácticas para abordarlos.
Problema: digestión incompleta
Posibles Causas:
- Condiciones de incubación subóptimas: temperatura o duración de incubación incorrectas.
- Inactivación enzimática: Desnaturalización de enzimas debido a manipulación o almacenamiento inadecuado.
- Condiciones subóptimas del tampón: pH del tampón, concentración de sal o presencia de inhibidores incorrectos.
Soluciones:
- Optimice las condiciones de incubación: asegúrese de que la reacción se mantenga a la temperatura óptima durante el período especificado de acuerdo con las instrucciones del fabricante.
- Maneje las enzimas con cuidado: almacene las enzimas adecuadamente a las temperaturas recomendadas y evite ciclos excesivos de congelación y descongelación. Utilice una cubeta de hielo inmediatamente después de sacarlo del congelador para evitar la desnaturalización.
- Verifique la compatibilidad del tampón: asegúrese de que el tampón utilizado sea adecuado para las enzimas elegidas y ajuste el pH o la concentración de sal si es necesario.
Problema: actividad estelar
Posibles Causas:
- Alta concentración de glicerol: La presencia de glicerol en el tampón de reacción puede provocar una escisión no específica.
- Condiciones de reacción subóptimas: Actividad enzimática influenciada por variaciones de temperatura, pH o fuerza iónica.
Soluciones:
- Optimizar las condiciones de reacción: Mantenga condiciones de reacción consistentes, incluida la temperatura y la composición del tampón, para minimizar la escisión no específica.
- Utilice tampones nuevos: Prepare tampones de reacción nuevos sin exceso de glicerol para evitar actividad enzimática no deseada.
Problema: sensibilidad a la metilación
Posibles Causas:
- metilación del ADN: La presencia de grupos metilo en bases de ADN específicas puede inhibir la escisión enzimática.
- Metilación de enzimas: Algunas enzimas de restricción pueden ser sensibles a la metilación, lo que afecta su actividad.
Soluciones:
- Utilice enzimas sensibles a la metilación: Seleccione enzimas que sean compatibles con el estado de metilación de la muestra de ADN.
- Prevención de la metilación: Realizar aislamiento de ADN de cepas bacterianas que no tienen actividad metilasa o utilizan enzimas específicas sensibles a la metilación.
Problema: contaminantes o inhibidores
Posibles Causas:
- Contaminantes en la muestra de ADN: La presencia de contaminantes como fenol, cloroformo o sales puede interferir con la actividad enzimática.
- Presencia de detergentes: Los detergentes de los kits de aislamiento de ADN pueden inhibir la actividad enzimática.
Soluciones:
- Purificar una muestra de ADN: Utilice métodos de purificación para eliminar los contaminantes antes de la digestión.
- Evite los detergentes: Si utiliza kits comerciales de aislamiento de ADN, asegúrese de lavarlos minuciosamente para eliminar los detergentes residuales.
Problema: mala eficiencia de ligadura
Posibles Causas:
- Fragmentos con extremos planos: Los fragmentos de ADN con extremos romos pueden tener una menor eficiencia de ligación en comparación con los fragmentos con extremos cohesivos.
- Bordes pegados no unidos: Los extremos adhesivos incompatibles pueden provocar una ligadura ineficaz.
Soluciones:
- Considere la compatibilidad con voladizos: Seleccione enzimas que generen extremos pegajosos compatibles para una ligadura eficiente.
- Utilice ADN ligasa T4: Utilice ADN ligasa T4, que puede ligar extremos romos y cohesivos, para mejorar la eficiencia de la ligadura.
Conclusión
La resolución de problemas de la digestión del ADN plasmídico requiere un enfoque sistemático para identificar y abordar problemas potenciales. Al comprender las causas subyacentes de la digestión incompleta o la ligadura ineficiente, los investigadores pueden implementar soluciones adecuadas para optimizar los resultados experimentales. Mediante una cuidadosa optimización de las condiciones de reacción, la selección de enzimas y las técnicas de preparación de muestras, se puede lograr una digestión confiable del ADN plasmídico, lo que facilita con confianza las aplicaciones posteriores de biología molecular.
Referencias
- Biolabs de Nueva Inglaterra (NEB). (Dakota del Norte.). Digestión con enzimas de restricción: protocolo. Obtenido del sitio web de NEB
- Addgene. (Dakota del Norte.). Analizador de secuencia. Obtenido del sitio web de Addgene
- Roberts RJ. (2005). Cómo las enzimas de restricción se convirtieron en los caballos de batalla de la biología molecular. Actas de la Academia Nacional de Ciencias de los Estados Unidos de América, 102(17), 5905–5908. https://doi.org/10.1073/pnas.0500923102
- Wilson GG, Murray NE. (1991). Sistemas de restricción y modificación. Revisión anual de genética, 25, 585–627.
- Pingoud A, Jeltsch A. (2001). Estructura y función de las endonucleasas de restricción tipo II. Investigación de ácidos nucleicos, 29 (18), 3705–3727.
- Sambrook J, Russell DW. (2001). Clonación molecular: manual de laboratorio (3ª ed.). Prensa del laboratorio Cold Spring Harbor.


