Actina versus miosina: una descripción comparativa

Los músculos están compuestos de proteínas especializadas que les permiten contraerse y producir movimiento. Entre estas proteínas, la actina y la miosina desempeñan papeles cruciales en la contracción muscular. Trabajan juntos para facilitar los movimientos voluntarios e involuntarios en humanos y otros animales. La actina y la miosina son parte integral de la función de las células musculares y también participan en diversos procesos celulares. Esta nota explora las diferencias entre actina y miosina, destacando sus papeles, estructuras y funciones en la contracción muscular.
actina
Definición y estructura
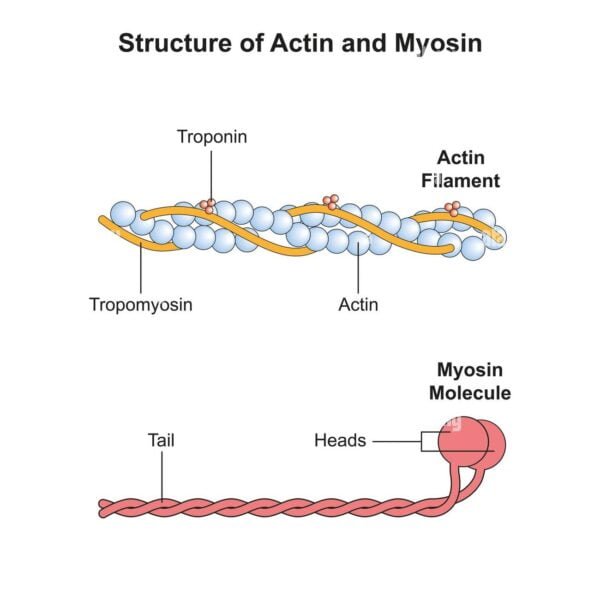
La actina es una proteína globular, conocida por formar filamentos delgados en las células musculares. En su forma monomérica, se llama actina G (actina globular). Cuando se polimeriza, la actina G forma actina filamentosa (actina F), que es un componente importante del citoesqueleto de las células eucariotas. Los filamentos de actina son cruciales para mantener la forma celular, permitir la motilidad celular y facilitar diversos procesos celulares como la división y el transporte intracelular.
Los filamentos de actina tienen aproximadamente 7 nanómetros de diámetro y varían en longitud, oscilando normalmente entre 2 y 2,6 micrómetros en las células musculares. Los filamentos están compuestos por dos hebras de moléculas de actina unidas entre sí, dándoles una estructura helicoidal.
Proteínas reguladoras
Los filamentos de actina están asociados con varias proteínas reguladoras, incluidas la tropomiosina y la troponina. La tropomiosina se une a lo largo del canal del filamento de actina y bloquea los sitios de unión de la miosina, mientras que la troponina, que se une a la tropomiosina, regula la interacción entre actina y miosina. La unión de los iones calcio a la troponina provoca un cambio conformacional que aleja la tropomiosina de los sitios de unión, lo que permite que la miosina se una a la actina e inicie la contracción.
Ubicación
En las células musculares, los filamentos de actina están presentes tanto en la banda A (anisotrópica) como en la I (isotrópica) del sarcómero. La banda I contiene únicamente filamentos de actina, mientras que la banda A contiene filamentos de actina y miosina. Los filamentos de actina están anclados al disco Z en los extremos del sarcómero.
Apariencia y rostro
Los filamentos de actina tienen una superficie lisa. Parecen más claros en los patrones de constricción cuando se observan bajo un microscopio en comparación con los filamentos de miosina. La suavidad de la superficie de actina se debe a la disposición constante de las subunidades de actina G a lo largo del filamento.
Función
Los filamentos de actina funcionan principalmente manteniendo la forma de las células, facilitando el movimiento e interactuando con la miosina para producir contracciones musculares. Durante la contracción, los filamentos de actina se deslizan en la zona H del sarcómero, que es la región central de la banda A.
Abundancia
Los filamentos de actina son más numerosos que los de miosina en las células musculares. Por cada filamento de miosina, hay aproximadamente seis filamentos de actina, lo que refleja su relativa abundancia.
miosina
Definición y estructura
La miosina es una proteína motora caracterizada por su capacidad de convertir la energía química de la hidrólisis del ATP en energía mecánica. Forma filamentos gruesos en las células musculares y desempeña un papel central en la contracción muscular. Las proteínas de miosina están compuestas de cadenas pesadas y cadenas ligeras, y las cadenas pesadas forman colas largas en forma de varillas y cabezas globulares que interactúan con los filamentos de actina.
Los filamentos de miosina son más gruesos y largos que los filamentos de actina y miden alrededor de 15 nanómetros de diámetro y de 4 a 5 micrómetros de longitud. Los filamentos están compuestos por múltiples moléculas de miosina organizadas en una estructura bipolar, con las cabezas sobresaliendo hacia afuera.
Proteínas reguladoras
Los filamentos de miosina están asociados con la meromiosina, que incluye las cadenas ligeras y los dominios de cabeza que interactúan con la actina. Las regiones principales de la miosina contienen actividad ATPasa, que es crucial para la conversión de ATP en energía mecánica.
Ubicación
Los filamentos de miosina se encuentran principalmente en las bandas A del sarcómero. Se superponen con los filamentos de actina en la banda A pero no están presentes en la banda I.
Apariencia y rostro
Los filamentos de miosina tienen una superficie rugosa debido a la presencia de cabezas de miosina que sobresalen. Aparecen más oscuros en los patrones de constricción en comparación con los filamentos de actina, lo que contribuye a la apariencia más oscura de la banda A.
Función
Los filamentos de miosina no se deslizan en la zona H durante la contracción. En cambio, forman puentes cruzados con filamentos de actina, que facilitan el deslizamiento de los filamentos de actina hacia el centro del sarcómero. Este mecanismo de deslizamiento es fundamental para la contracción muscular.
Abundancia
Los filamentos de miosina son menos abundantes que los filamentos de actina. Normalmente, un único filamento de miosina interactúa con múltiples filamentos de actina, lo que refleja su menor número en las células musculares.
La contracción muscular se ve facilitada por el modelo de filamento deslizante, que describe cómo interactúan la actina y la miosina para producir movimiento. Cuando un músculo es estimulado por una neurona motora, se liberan iones de calcio del retículo sarcoplásmico. Estos iones se unen a la troponina, provocando un cambio en la tropomiosina que expone los sitios de unión de la actina.
Las cabezas de miosina, que se activan mediante la hidrólisis del ATP, se unen a los sitios expuestos de la actina para formar puentes cruzados. Luego, las cabezas de miosina giran, tirando de los filamentos de actina hacia el centro del sarcómero. Esta acción acorta el sarcómero, lo que provoca la contracción muscular. El proceso se repite hasta que estén disponibles ATP y iones de calcio.
Diferencias clave entre actina y miosina
| Aspecto | actina | miosina |
| Definición y función | Proteína globular que forma filamentos delgados; Participa en la contracción muscular, la forma celular, la motilidad y la división. | Proteína motora; convertir la hidrólisis de ATP en energía mecánica; Forma filamentos gruesos e interactúa con la actina para la contracción muscular. |
| Estructura | Filamentos delgados, de unos 7 nm de diámetro; Estructura helicoidal hecha de actina G. | Filamentos gruesos, de unos 15 nm de diámetro; Consiste en una cola larga en forma de varilla y cabezas globulares. |
| Tamaño | Corto (2-2,6 µm de largo), delgado (0,005 µm de diámetro). | Largo (4-5 µm de largo), grueso (0,01 µm de diámetro). |
| rasgos faciales | Superficie lisa. | Superficie rugosa debido a las cabezas de miosina que sobresalen. |
| Proteínas reguladoras | Tropomiosina (bloquea los sitios de unión de miosina); Troponina (se une al calcio y regula la posición de la tropomiosina). | Meromiosina (incluye los dominios de cabeza y cola, implicados en la formación de puentes cruzados). |
| Ubicación en el Sarcómero | Se encuentra tanto en las bandas A como en I; Anclado con discos Z. | Se encuentra principalmente en las bandas A; anclado en la línea M. |
| Abundancia | Más abundante; normalmente seis filamentos de actina por cada filamento de miosina. | Menos abundante; un filamento de miosina por cada seis filamentos de actina. |
| Formación de puentes cruzados | No forma puentes transversales directamente; Proporciona sitios de unión para la miosina. | Forma puentes cruzados con los filamentos de actina durante la contracción. |
| Asociación con ATP | No asociado directamente con ATP. | Directamente asociado con ATP; La actividad ATPasa impulsa el movimiento. |
| Mecanismo de deslizamiento durante la contracción | Se desliza hacia la zona H durante la contracción. | Permanece estacionario mientras tira de los filamentos de actina hacia el centro del sarcómero. |
| Extremos y lazos | Un extremo libre (extremo con púas o agrandado), el otro extremo unido a un disco Z (extremo puntiagudo o faltante). | Ambos extremos libres; las cabezas permanecen asociadas con ATP. |
| Aspecto bajo microscopía | Aparece como estrías más claras (bandas I). | Aparece como estrías más oscuras (bandas A). |
| Roles adicionales | Forma microfilamentos en el citoesqueleto; Participa en la división y motilidad celular. | Funciona como motor molecular en la contracción muscular y otros procesos celulares según el tipo de miosina. |
Conclusión
La actina y la miosina son fundamentales para la función muscular y diversos procesos celulares. La actina forma filamentos delgados que brindan soporte estructural e interactúan con la miosina durante la contracción. La miosina, como proteína motora, forma filamentos gruesos y es esencial para generar la fuerza necesaria para el movimiento muscular. Comprender las diferencias entre estas dos proteínas resalta sus distintas funciones en la fisiología muscular y su función cooperativa en el mecanismo de contracción muscular.



