VSEPR para química AP y geometría molecular – Escuela secundaria/Honores/Recursos de química AP®

Dominar las formas VSEPR: conceptos clave para AP Chem
En el mes de octubre, muchos profesores a menudo se encuentran abordando la Unidad 2.7 del material del curso AP de Química. Esta unidad, que se centra en ‘VSEPR‘(Repulsión del par de electrones de la capa de valencia) teoría y ‘Hibridación de enlaces para Química AP. Los educadores suelen utilizar este tiempo para presentar a sus estudiantes las complejidades de la geometría molecular, los ángulos de enlace y los conceptos de hibridación, comenzando a trabajar mientras sientan las bases para principios más avanzados de la química. Por ejemplo, la teoría VSEPR es esencial para comprender las formas moleculares y las polaridades en las que influyen. fuerzas intermoleculares (FMI).
En este artículo, nuestro objetivo es proporcionar una guía sencilla para que los profesores naveguen por «VSEPR para química AP». Entraremos al Capitolio Tema 2.7 VSEPR e hibridación de bonos y discutir el marco de descripción del curso y exámenes del College Board (CED).
Problemas que enfrentan los profesores
Aprender el concepto de formas VSEPR en química puede ser fascinante y desafiante. Muchos profesores encuentran dificultades al intentar transmitir la naturaleza abstracta de las formas moleculares a sus alumnos. Después de todo, las moléculas no son visibles al ojo. Sin embargo, comprender estas formas es fundamental para comprender el comportamiento químico y las interacciones moleculares. En este capítulo, nuestro objetivo es ayudar a los educadores a abordar este tema crucial de manera efectiva.
Conectando formas moleculares con el mundo real: un enfoque del aprendizaje

Para que los formularios VSEPR sean más accesibles y atractivos para los estudiantes, es crucial cerrar la brecha entre la teoría abstracta y la relevancia práctica. Al ayudar a los estudiantes a relacionar las formas moleculares con sus experiencias cotidianas, podemos presentar este concepto fundamental con significado y contexto. Por ejemplo, los profesores pueden comenzar la lección explorando cómo las formas moleculares afectan las propiedades de las sustancias que se encuentran en la vida cotidiana, como las notables propiedades del agua. Un ejemplo tangible puede servir como la capacidad del agua para sustentar la vida a temperaturas bajo cero, explicada por el hielo flotante, y su capacidad para disolver muchas sustancias, permitiendo diversas reacciones químicas. Además, se puede explorar la importancia de las formas moleculares en el diseño de fármacos. Los profesores pueden demostrar diferentes fármacos y discutir sus formas únicas, mostrando cómo la geometría molecular influye en su eficacia. Por ejemplo, muchos medicamentos actúan inhibiendo las enzimas del cuerpo. Estos medicamentos están diseñados con formas que coinciden con el sitio activo de la enzima, como una llave que encaja en una cerradura. Estos ejemplos representan sólo la punta del iceberg; Una gran cantidad de aplicaciones del mundo real resaltan la importancia de comprender las formas moleculares. Al forjar estas conexiones, podemos brindar a los estudiantes una apreciación más profunda de la importancia que tienen las formas moleculares en el mundo que los rodea. Después de fomentar debates significativos, los profesores pueden guiar a los estudiantes a predecir las formas de las moléculas, solidificando su comprensión de este concepto esencial.
VSEPR para química AP
VSEPR para Química AP es un tema muy importante. Los estándares de Química AP exigen que los estudiantes desarrollen una comprensión profunda de los fenómenos químicos y la capacidad de construir representaciones y modelos para diversos conceptos químicos. En particular, se espera que los estudiantes aprendan:
| Habilidades | Descripción |
|---|---|
| Interpretar representaciones gráficas | Los estudiantes aprenden a interpretar representaciones gráficas de cambios de energía potenciales a medida que los átomos se acercan entre sí. Usan estas representaciones para explicar longitud óptima de unión y comprender los factores que determinan la formación de enlaces. |
| Construir representaciones y modelos | Los estudiantes practican la construcción de representaciones y modelos para explicar fenómenos químicos, incluyendo sólidos iónicos y metálicos. Estos modelos sirven como base para realizar afirmaciones y predicciones sobre el comportamiento de la sustancia. *Teoría REEPRV no se aplica para sólidos iónicos y metálicos. |
| Aplicar la teoría VSEPR | Los estudiantes utilizan la teoría VSEPR (Repulsión de pares de electrones de la capa de valencia) para dibujar estructuras de Lewis de moléculas y predecir sus geometría tridimensional y polaridad. Esto implica comprender cómo los pares de electrones afectan la forma molecular. |
| Conecte las teorías químicas en escalas | Los estudiantes pueden explicar las conexiones entre Fenómenos a nivel atómico y propiedades macroscópicas. Por ejemplo, entienden cómo electronegatividad y energía de ionización relacionado a tipos de bonos y las características generales de la sustancia. |
| Evaluar modelos | Los estudiantes trabajan con conceptos químicos como Ley de Coulomb, carga formal y resonancia. evaluar la precisión de los modelos en la representación de estructuras a nivel de partículas y observaciones macroscópicas. |
| Predicción de propiedades moleculares | Los estudiantes practican predecir y describir. formas moleculares, Ángulos de enlace y polaridades. Residencia en estructuras de lewis. También calculan y combinan cargos formales para la estructura predicha de una molécula. |
Tenga en cuenta los errores comunes cometidos por los estudiantes destacados por CED. Estos incluyen errores relacionados con los electrones de valencia, violaciones de las reglas del octeto y confusión entre la geometría molecular y los ángulos de enlace.
En resumen, los estándares de Química AP requieren que los estudiantes tengan una sólida comprensión de la estructura molecular, las teorías de enlaces y la capacidad de usar estos conceptos para hacer predicciones y respaldar afirmaciones sobre diversas propiedades y fenómenos químicos. Se espera que los estudiantes practiquen ampliamente estas habilidades para tener éxito en el curso y en el examen AP.

Cómo abordar errores comunes
Para ayudar a los estudiantes a abordar errores comunes relacionados con los electrones de valencia, violaciones de las reglas de los octetos y confusión entre la geometría molecular y los ángulos de enlace, los educadores pueden emplear varias estrategias y recursos de aprendizaje. A continuación se ofrecen algunos consejos para aprender «VSEPR para química AP»:
| Aprendiendo estrategias | Descripción |
|---|---|
| Visualización clara | Mejore la comprensión mediante simulaciones interactivas como herramientas PhET o software de modelado molecular. Alternativamente, puedes elegir materiales tangibles como malvaviscos con palillos o bolas de espuma suave con alambres para facilitar el aprendizaje. |
| Practica con estructuras de Lewis | Anime a los estudiantes a practicar dibujando estructuras de Lewis para varias moléculas e iones. Resalte la importancia de contar correctamente los electrones de valencia y distribuirlos para satisfacer la regla del octeto. Proporcione muchos ejemplos y moléculas progresivamente complejas para la práctica. |
| Estructuras de resonancia | Enseñe a los estudiantes cómo identificar y dibujar estructuras de resonancia. Enfatice que las estructuras de resonancia son representaciones diferentes de la misma molécula y contribuyen a la estructura molecular general. |
| Geometría molecular versus ángulos de enlace | Aclarar la distinción entre geometría molecular (la disposición espacial de los átomos, incluidos los pares libres) y ángulos de enlace (los ángulos entre átomos unidos). Utilice ejemplos de la vida real y actividades prácticas para reforzar este concepto. |
| Teoría VSEPR | Introdujo la teoría VSEPR (Repulsión de pares de electrones de la capa de valencia) como herramienta para predecir la geometría molecular y los ángulos de enlace. Proporcionar problemas de práctica que involucren campos de electrones y ángulos de enlace. |
| Trabajo en grupo y aprendizaje entre pares | Anime a los estudiantes a trabajar en grupos o parejas para resolver problemas de forma colaborativa. El aprendizaje entre pares puede ser muy eficaz para mejorar la comprensión. |
Al implementar algunas de estas estrategias y enfatizar la importancia de la práctica, la clarificación y la comprensión profunda de los conceptos fundamentales, los educadores pueden ayudar a los estudiantes a superar desafíos comunes en la comprensión de los electrones de valencia, la regla del octeto y la relación entre la geometría molecular y los ángulos de enlace.
Cómo puede ayudar Viziscience
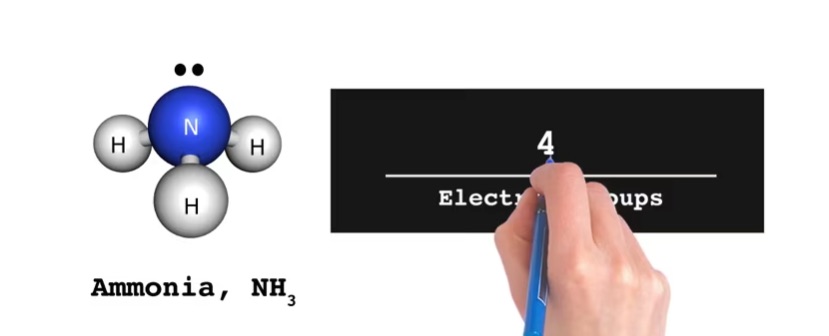
Viziscience ofrece una completa VSEPR para química AP. Esta unidad es ideal para estudiantes que son nuevos en química o que buscan avanzar rápidamente al nivel requerido para Química AP. Esta unidad es un recurso valioso tanto para profesores como para estudiantes. Proporciona un camino estructurado y eficiente para aprender química, completo con ayudas visuales de alta calidad, videos educativos, texto explicativo claro, diagramas ilustrativos y cuestionarios de verificación de conceptos.
Para los profesores, este recurso puede ser una solución que les permitirá ahorrar tiempo y eliminar la necesidad de recopilar materiales y lecciones. En cambio, pueden confiar en una unidad bien estructurada y organizada que cubra los fundamentos de la química y haga que los estudiantes realicen una transición sin problemas al nivel de Química AP.
Para los estudiantes, la unidad Viziscience ofrece una experiencia de aprendizaje atractiva y de apoyo. Las ayudas visuales y los vídeos hacen que los conceptos complejos sean más accesibles, y las pruebas de verificación de conceptos garantizan que los estudiantes puedan evaluar su comprensión a medida que avanzan.
En resumen, la unidad integral de Viziscience es una herramienta valiosa que simplifica el proceso de aprendizaje de química tanto para educadores como para estudiantes, haciendo el viaje desde lo básico hasta el nivel de Química AP eficiente y eficaz.



